In-Fusionクローニングは、PCR断片と線状化ベクターの両末端15塩基の相同配列を利用して効率よくクローニングする技術です。制限酵素やライゲーションキットによる切り貼りが一切必要なく、In-Fusion反応自体もわずか15分で完了するため、制限酵素/ライゲーションを使った手法に比べると、実験時間を約1日短縮することができます。また、一挙に複数の断片を挿入するマルチクローニングも可能なので、作業を大幅にカットできます。
原理
In-Fusionクローニングのメカニズムは、リコンビナーゼがDNA断片とベクターの間の特定の15bp同一配列を認識し、結合することにより機能します。この際、結合は非常に高精度で行われ、遺伝子操作の誤りをほぼ排除します。
特徴
使用する任意のベクターの末端配列を利用してクローニングを行うため、あらゆるベクターが使用でき、余分な配列が一切付加されず、しかもディレクショナルクローニングを行うことができる優れた手法です。
実験手順
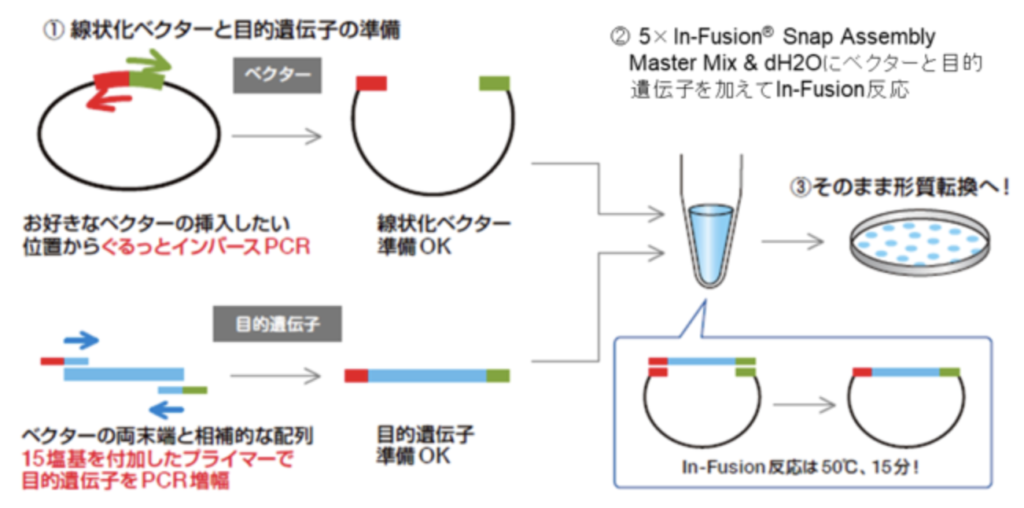
In-Fusionクローニングの手順は以下の通りです:
- 1. PCR増幅を行って目的のDNA断片を取得します。このとき、PCRプライマーの設計を工夫して、DNA断片の両端にはIn-Fusionクローニングに必要な15bpの配列を追加します。
- 2. 使用したいベクターに対して、上述の15bpを追加する形でインバースPCRを行います。
- 2. 次に、リコンビナーゼを含むIn-Fusionミキシングを用いて、DNA断片とベクターDNAを混合します。
- 3. 特定の条件下でのインキュベーションにより、リコンビナーゼが活性化し、DNA断片とベクターDNAの間の結合が始まります。
- 4. 結合が完了すると、In-Fusionミキシングを停止し、DNA断片がベクターに結合した生成物が得られます。
TAクローニングとの比較
In-Fusionクロニングは速度や精度の点で、従来の遺伝子クローニング手法、例えば、リガーゼ依存的な方法やTAクローニングなどと比較して優れています。
ただし、In-Fusionクローニングキットは他の遺伝子クローニング手法と比較して少々高価です。
Gibson Assemblyとの比較
Gibson Assemblyもまた、複数の遺伝子断片を効率的に接合するクローニング手法です。
両方は多くの共通点を持っていますが、主な違いはGibsonアッセンブリはプロトコルがやや複雑であり、結果の精度が少し劣る点です。
しかし、Gibsonアッセンブリではより長いオーバーラップシーケンス(通常は20-40bp)を使用するため、より大きな二つ以上のフラグメントを接合するのに適しています。
参考書籍
バイオ実験基本セット
- これからはじめる人のためのバイオ実験基本ガイド (KS生命科学専門書)
- イラストでみる超基本バイオ実験ノート―ぜひ覚えておきたい分子生物学実験の準備と基本操作 (無敵のバイオテクニカルシリーズ)
- 改訂 バイオ試薬調製ポケットマニュアル〜欲しい試薬がすぐにつくれる基本操作と注意・ポイント
- バイオ実験法&必須データポケットマニュアル―ラボですぐに使える基本操作といつでも役立つ重要データ
- バイオ実験超基本Q&A―意外に知らない、いまさら聞けない
バイオ実験イラストレイテッド
- バイオ実験イラストレイテッド〈1〉分子生物学実験の基礎 (細胞工学別冊 目で見る実験ノートシリーズ)
- バイオ実験イラストレイテッド②
- バイオ実験イラストレイテッド〈3+〉本当にふえるPCR (目で見る実験ノートシリーズ)
- バイオ実験イラストレイテッド④
- バイオ実験イラストレイテッド〈5〉タンパクなんてこわくない (目で見る実験ノートシリーズ)
- バイオ実験イラストレイテッド⑥
- バイオ実験イラストレイテッド⑦



コメント