現在の私の研究: qmer法/翻訳速度ベクトルの礎となった、研究について紹介します。この記事では特に学部4年生時代の研究(以下の論文の内容)について説明します。
Takaya, A., Sato, Y., Shoji, T., & Yamamoto, T. (2013). Methylation of 23S rRNA nucleotide G748 by RlmAII methyltransferase renders Streptococcus pneumoniae telithromycin susceptible. Antimicrobial agents and chemotherapy, 57(8), 3789-3796.
研究テーマと私のアプローチ
「肺炎球菌に特に効く抗生物質にテリスロマイシン(Telithromycin: TEL)という抗生物質があるのでその菌種特異性の理由を調べよ」が私に与えられたテーマでした。
TELは原核生物の50S リボソームの新生ペプチドトンネル内のペプチジルトランスフェラーゼ活性中心 (Peptidyl Transferase Center: PTC)付近に存在する23S リボソームRNA (rRNA)の752番目のアデニン (A752) および23S rRNA 2058番目のアデニン (A2058) の2箇所に結合して、翻訳を阻害することで効力を発揮する半合成(*1)の抗生物質です(下図)。
*1:微生物などが合成した物質を基質として化学合成されたもの。
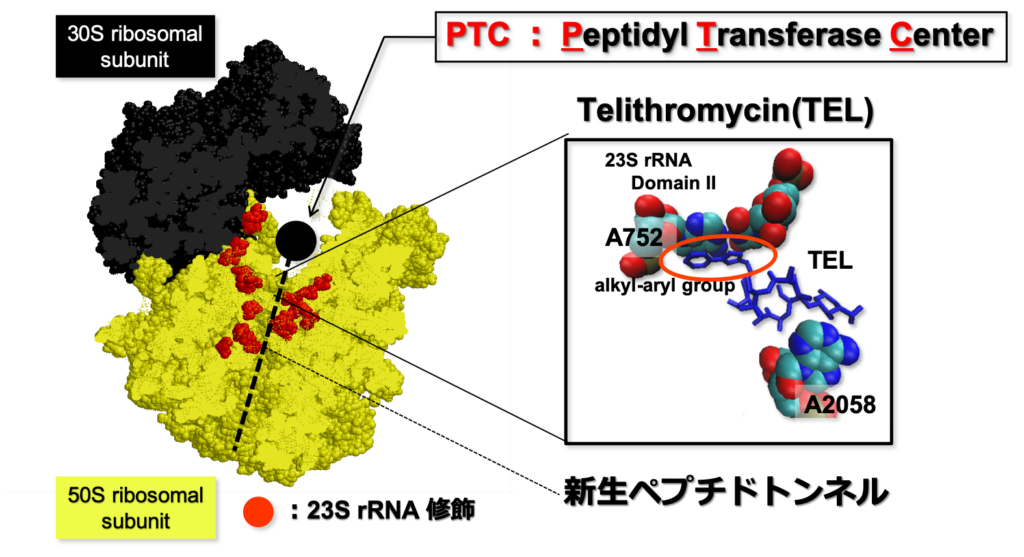
当時登場して間もない次世代シーケンサ(Next Generation Sequencer: NGS)を利用することを検討しました。 つまり、肺炎球菌をTELを含む培地で培養し、人工的に研究室で耐性菌を発生させます。得られた耐性菌の全ゲノムをシーケンス(=ゲノムの配列を決定すること)し、変異が生じていた遺伝子のいずれかが肺炎球菌のTELに対する感受性に関わるだろう、という作戦です。
肺炎球菌の入手
右図で、S1は臨床から分離されてきた(=肺炎の患者さんに巣食っていた肺炎球菌を病院からとってきた)肺炎球菌です。この研究ではS1を野生型の株(=野生株)として扱います。
BHIYは肺炎球菌を培養するために使用する培養液の1つで、透明な黄色〜オレンジ色をしています。まずはS1を37℃で5% CO2の環境のもと4時間、試験管の中で培養して増殖させました。なお、5% CO2はヒトの肺の奥深く(=肺胞)における二酸化炭素濃度で、本来肺炎球菌が細胞分裂をして増殖する場所である環境を模擬するために設定してあります。
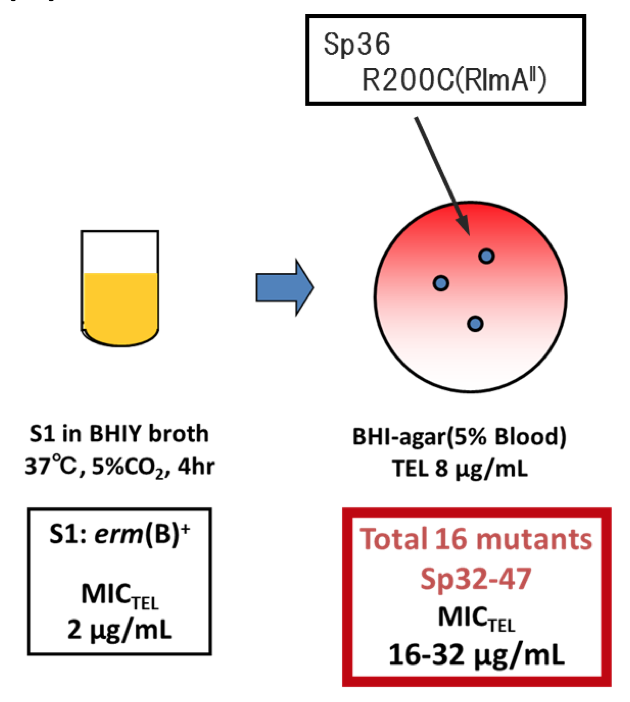
また、MICは Minimum Inhibitory Concentration の略で、肺炎球菌S1は2μg/mLのTELの濃度で生育が抑制されることを意味しています。erm(B)+は、そういう名前の遺伝子を持っていることに対する但書です。肺炎球菌の野生型と言えば通常はerm(B)を保有していないため、ここではそのように断ってあります。
耐性菌の分離と全ゲノムシーケンス
耐性菌を得るためにMICより高濃度のTELを含む寒天培地(5% horse blood(馬の血)を含むBHI-agar(BHI寒天培地))にS1の培養液を塗布し、同様に37℃、5% CO2の条件下で培養しました。この培地にはMICの濃度より高いTELが含まれているため、通常はコロニーが生じることはありませんが、たまたまTEL耐性という表現型に係る変異が生じていた細胞が、塗布した培養液内に含まれていた場合は、コロニーが出来上がります。
もう少し詳しく説明すると、肺炎球菌が培養液内で増殖をする際に行う細胞分裂において、ゲノムDNAを複製する際、僅かな確率でコピーミスが生じた細胞が出現します。その細胞がたまたまTEL耐性化に重要であった変異を抱えていた場合はMIC以上の濃度のTELを含む培地上でも細胞分裂が生じて増殖しコロニーが出来上がります。
本実験では容易に耐性を獲得したコロニーが得られました。そこで、16つのコロニーを選んでSp32-47と命名し、-80°C(ディープフリーザー)にグリセロールストックを作製して保存しました。そして、S1およびSp36についてゲノムを抽出し、ライブラリを作製してシーケンスしました。
TEL耐性とRlmAIIの関係
作成は成功しました。TEL耐性株Sp36のゲノムに生じていた変異の1つにrRNAメチル化酵素RlmAIIのアミノ酸変異をもたらすものがありました。そして、RlmAIIによるメチル化部位は23S rRNA 748番目のグアニン (G748)、すなわち、TEL結合場所の付近でした。
また、RlmAIIは肺炎球菌と一部の細菌にのみコードされている酵素であり、TELが肺炎球菌に特に良く効くという事実に対しても辻褄が合いました。
更に、Sp32-47のRlmAII遺伝子のDNA配列を読んでみると、場所は違えど、全ての株でRlmAIIをコードする遺伝子配列内に変異が生じていました(下表)。つまり、肺炎球菌のTEL耐性化は、RlmAIIを失活させるような変異が生じることで起こる現象であることが考えられました。
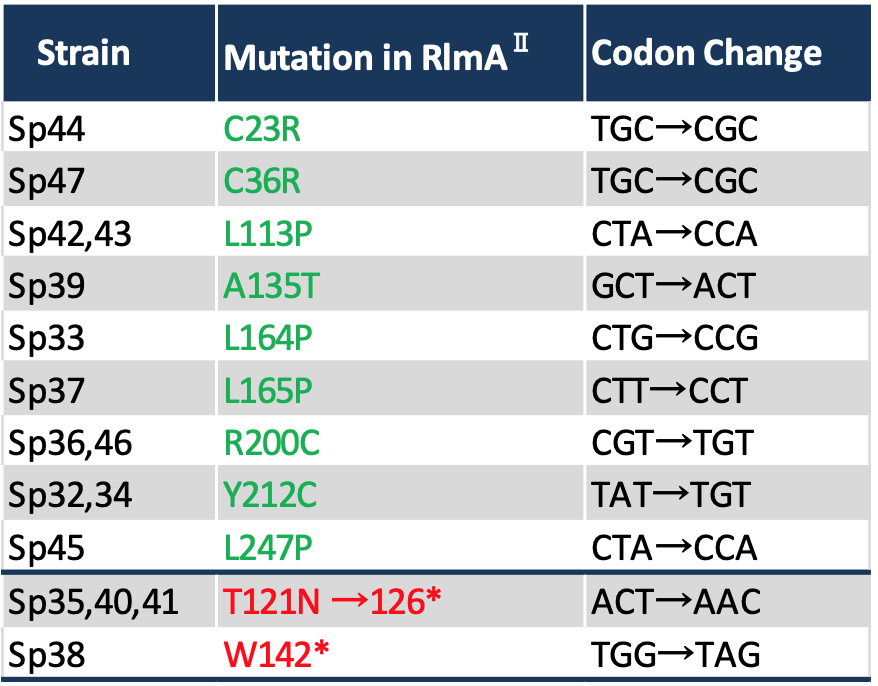
TEL耐性とG748メチル化の関係
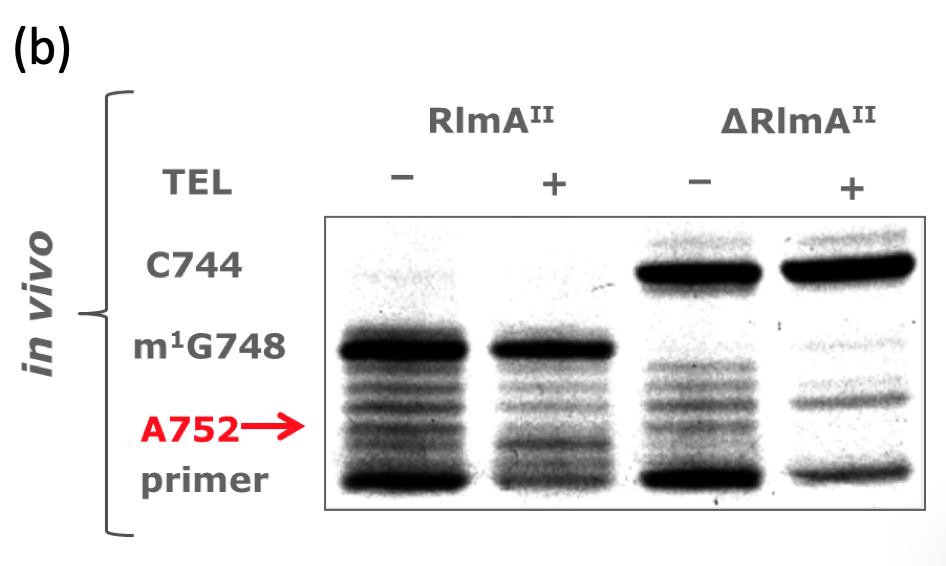
変異が生じていただけでは、メチル化の機能が損なわれていることにはなりません。そこで、Sp32-Sp47からtotal RNA (rRNA、tRNA、mRNA、miRNA、その他のnon-coding RNA等全てを含むRNA画分のこと)を抽出し、G748手前にアニーリングするPrimerを用いて逆転写によりG748のメチル化の有無を調べたところ(下図(A))、Sp32-Sp47では野生型と比べてメチル化が消失していた結果が得られました(下図(B))。
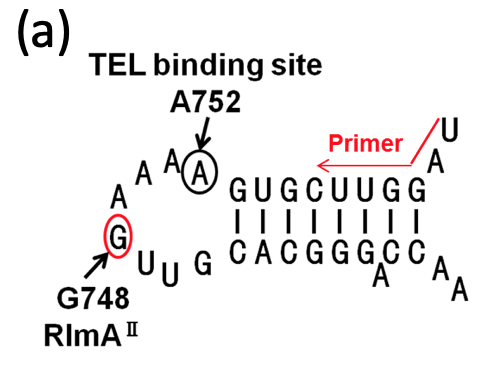
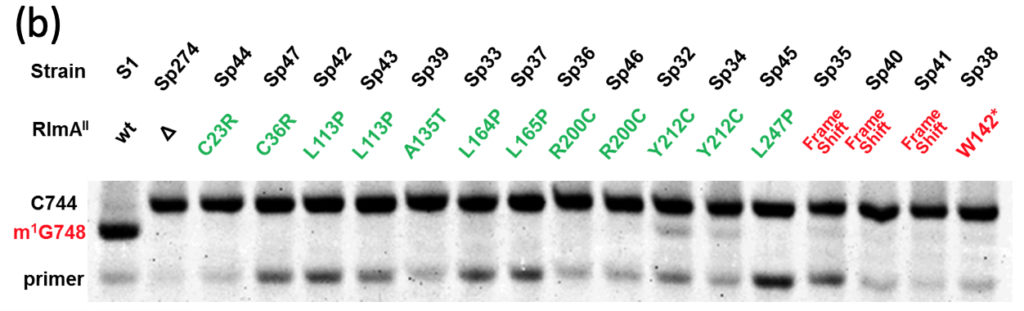
なお、逆転写は SuperScript III Reverse Transcriptase により行いました。この逆転写によりメチル化の有無を調べる実験は、 Primer Extension 法と呼ばれるもので、G748にメチル基が存在していた場合、逆転写反応を進めるために必要な塩基間での水素結合が形成されずに逆転写反応がそこで停止することを利用して、メチル化の有無をcDNAの長さの違いとして検出する実験です。
cDNAの長さを調べる方法は電気泳動です。電気泳動にも様々な種類がありますが、今回のように短い1本鎖のDNAに対する電気泳動は、ポリアクリルアミド電気泳動(PAGE)で行います。また、長さが移動距離に反映されるように、8Mの尿素を含ませて高次構造を壊して(=変性させて)泳動させます。検出は、Primer の5’末端に予め化学修飾による付加しておいた蛍光物質であるFITCを利用します。すなわち、泳動後のゲルに適当な波長の光を照射し、その蛍光を検出(撮影)することでcDNAのゲルにおける位置を特定します。撮影により上図の(B)のような図が得られます。
クローニングによる詳細な検討
Sp32-47にはRlmAII以外にも変異が生じていた可能性があります。従って、TEL耐性という表現型がRlmAIIの失活に起因するとは言い切れません。
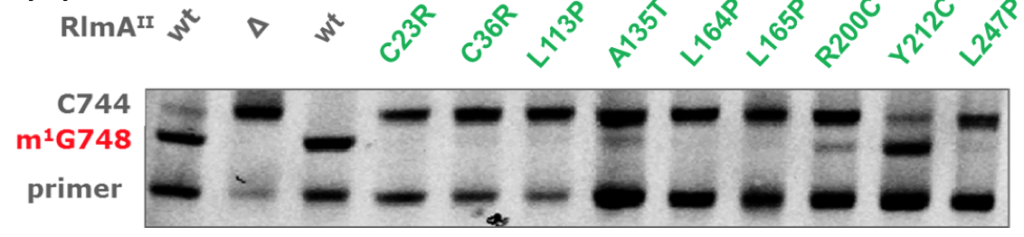
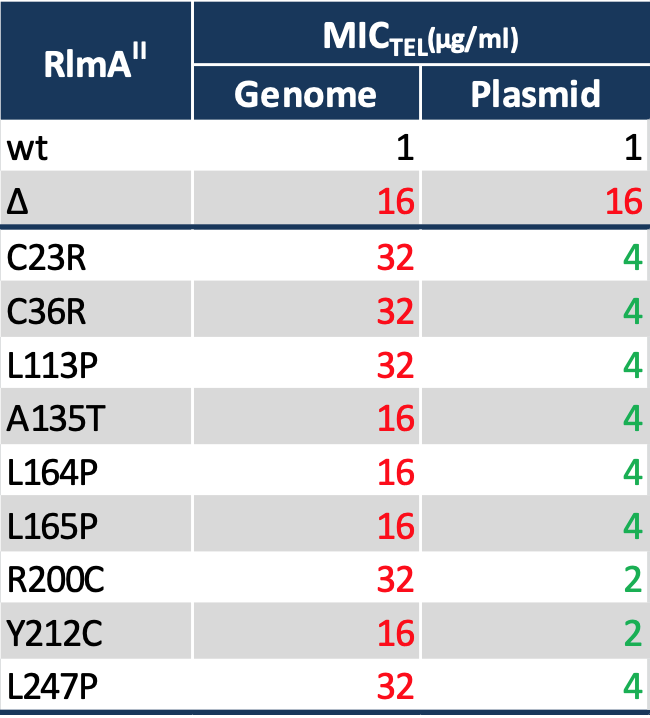
そこで、野生株のRlmAIIをコードする遺伝子を二重相同組換えを利用して欠損させたところ、TEL耐性となりました(下表Δ)。また、同様に Primer Extension 法で欠損株の G748 メチル化を調べたところ、消失していました(下図Δ)。なお、二重相同組換えは、相同組換えを利用して、欠損させたい遺伝子の内部に別の遺伝子を入れ込むことで対象遺伝子の機能させなくする方法です。
更に、アミノ酸が変異したRlmAII遺伝子をクローニングして、RlmAII遺伝子を欠損させた株にプラスミドで導入してもTEL耐性でした(下表)。メチル化も野生株と比べて減少していました(下図)。なお、完全にメチル化が消失せずに減少に留まる理由は、プラスミドによりRlmAIIが過剰発現しているからと考えられます。
更に、野生型のRlmAII遺伝子をクローニングして導入したところTEL感受性でした(下表wt)。G478メチル化は存在していました(下図wt)。
これらの結果により、RlmAIIアミノ酸変異は酵素の失活をもたらし、それによって耐性化が生じるという機序の詳細を示すことができました。
構造メカニズムを証明
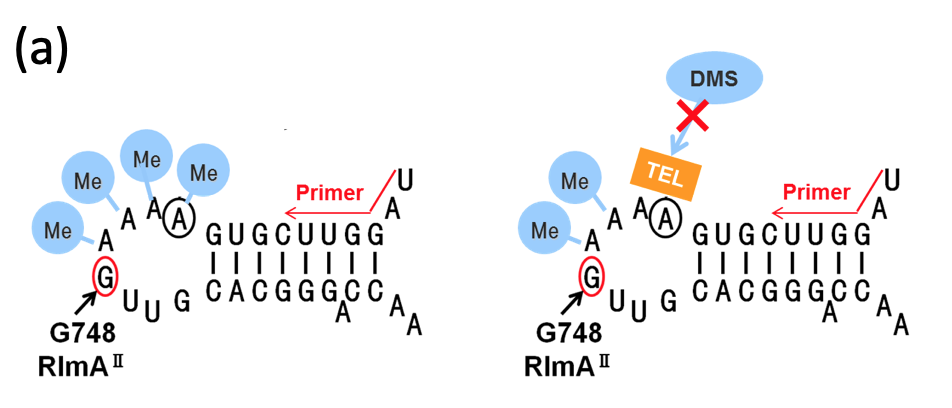
メチル化が消失した肺炎球菌においては、TELがリボソームに結合していないはずです。これについてRNA footprint 法で検討しました。
つまり、野生株およびTEL耐性株の培養液にTELを加え、その後にRNAの塩基部分をメチル化するジメチルサルフェート(DMS)を加えました。この実験のポイントは、TELが結合している部分はDMSによるメチル化から保護されることです(下図(A))。
DMSを加えた後は、リボソームRNAを抽出し、リボソームRNAのメチル化の程度を Primer Extension 法により調べました。その結果、TEL耐性株ではTEL結合に関わるリボソームRNAの部位がメチル化されていなかったことに対し、野生型ではされていました(下図(B))。
この結果は、一見すると仮説に反するものですが、少なくともG748メチル化の有無はTELの結合を変化させることを示していることわかります。TEL耐性株ではTELが有効に結合せず、おそらく様々な形態で結合していたためDMSによるメチル化から保護されたのでしょう。また、そのような不安定な結合はリボソームの合成を阻害しないのでしょう。以上より、RlmAIIによるメチル化消失がTELの結合に関わっているという、より詳細な機序を明らかにすることが出来ました。
シミュレーションによる構造メカニズムの証明
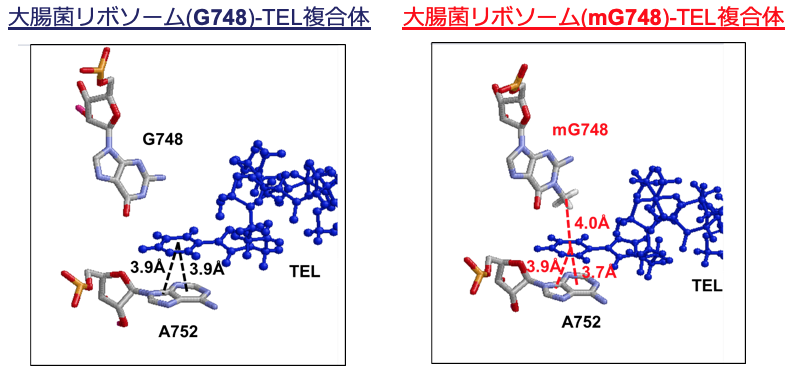
RlmAIIによるメチル基の有無がTELのリボソームへの結合にどのような影響を与えるか、分子動力学計算により立体構造を調べてみたところ、下図のように、メチル基とTELは疎水性相互作用により両側から挟まれていた状態で結合していること、そして、欠損株ではその「挟み」が消失していることが明らかとなりました。
総括
肺炎球菌に特にTELが効く理由は、肺炎球菌と一部の細菌にのみ存在するRlmAIIによる23SリボソームRNAのG748メチル化がTELのリボソームへの結合を強化していたからであると明らかになりました。
以上の結果は私が学部4年(B4)の1年間で成し遂げたものであり、B4の3月に開催された第86回日本細菌学会にて発表したところ、ポスドクなどの若手研究者を退けて優秀発表賞の取得となりました。また、この結果は以下の論文に成果報告をしました。
Takaya, A., Sato, Y., Shoji, T., & Yamamoto, T. (2013). Methylation of 23S rRNA nucleotide G748 by RlmAII methyltransferase renders Streptococcus pneumoniae telithromycin susceptible. Antimicrobial agents and chemotherapy, 57(8), 3789-3796.




コメント