タンパク質分析のための重要な技術の一つであるSDS-PAGE(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis)について解説します。SDS-PAGEはタンパク質を分離・解析するための電気泳動法であり、その原理や手法、応用について詳しく説明します。
参考書籍
バイオ実験基本セット
- バイオ実験イラストレイテッド〈1〉分子生物学実験の基礎 (細胞工学別冊 目で見る実験ノートシリーズ)
- これからはじめる人のためのバイオ実験基本ガイド (KS生命科学専門書)
- イラストでみる超基本バイオ実験ノート―ぜひ覚えておきたい分子生物学実験の準備と基本操作 (無敵のバイオテクニカルシリーズ)
- 改訂 バイオ試薬調製ポケットマニュアル〜欲しい試薬がすぐにつくれる基本操作と注意・ポイント
- バイオ実験法&必須データポケットマニュアル―ラボですぐに使える基本操作といつでも役立つ重要データ
- バイオ実験超基本Q&A―意外に知らない、いまさら聞けない
サザンブロッティングの参考書
- バイオ実験イラストレイテッド⑤
SDS-PAGEの原理
SDS-PAGEはタンパク質を分離するためにゲル電気泳動を利用します。この技術の基本原理は、タンパク質の分子量に基づいて分離することです。以下にSDS-PAGEの主要な原理を説明します。
SDSの役割
SDSはSodium Dodecyl Sulfate(ラウリル硫酸ナトリウム)の略で、タンパク質を変性させ、線状の構造にします。SDSはタンパク質の疎水性と電荷を一様にし、タンパク質分子を均一な負電荷で覆います。具体的には、SDSは水溶性タンパク質1 g当たり約1.4 g結合してSDS-タンパク質複合体を形成します。これにより、タンパク質の分子量に関係なく、電気泳動において移動速度がタンパク質の分子量に比例するようになります。
なお、SDSは強力な陰イオン界面活性剤なので、膜タンパク質などの不溶性タンパク質の可溶化にも適しています。
ちなみに、タンパク質の変性はβ-メルカプトエタノールやDTT(Dithiothreitol)などの還元剤を添加してタンパク質のS-S結合(ジスルフィド結合)を切断することでも行うことがあります。
ポリアクリルアミドゲルの利用
ポリアクリルアミドゲルは、SDS-PAGEにおいてタンパク質分離の基盤として使用されます。ゲルはポアサイズが異なる複数の領域から成り、タンパク質分子のサイズに応じて移動速度が変わります。このため、ゲル上でタンパク質が分離されます。
ゲル中の細孔径が密なため100~200 KDa以下のタンパク質やポリペプチドを分離するのに適しています。目的のタンパクのサイズによって、アクリルアミドゲルの濃度を7.5%〜15%程度の範囲から選んで作製します。
ちなみに、ゲル化の重合反応は吸熱反応なので、温度が高い部屋で放置しておくと早く完成します。
SDS-PAGEの手法
SDS-PAGEの手法には以下のステップが含まれます。
サンプルの調製
サンプルタンパク質をSDSサンプルバッファーに混ぜ、ボイリング(加熱)して変性させます。これにより、タンパク質がSDSで包まれ、均一な負電荷を持つ状態になります。
なお、SDSサンプルバッファーは、変性剤やSDS等を濃縮してまとめた溶液のことで、BPB(ブロモフェノールブルー)やグリセロールと共に、Tris-HCl等のバッファーに濃縮した状態で-20℃や4℃に保存しておき、必要な際に取り出して使うよう準備しておくようにします。
ゲルのキャスティング
ポリアクリルアミドゲルをキャスティングし、その上にサンプルウェルを設けます。ゲル中に電気泳動バッファーを充填し、電気泳動槽にセットします。
作製方法はこちら等を参考にして下さい。あるいはプレキャストという作製済みのゲルを購入して下さい。自作すれば安いですが、購入すれば再現性が良くなります。
サンプルのロード
サンプルをゲル上にロードします。通常、分子量マーカーも同時にロードし、タンパク質の分子量を推定する基準とします。
ロードすべきサンプル内に含まれるタンパク質量は大体決まっており、
を参考にしてください。
この量を達成するためには、細胞種にもよりますが、106から108の細胞数を確保しておきます。これは普段の実験から経験的に覚えておく量です。
電気泳動
電気泳動槽に電気を印加し、タンパク質をゲル内で移動させます。SDSによって、タンパク質は分子量に応じて異なる距離まで移動し、分離されます。
通電条件に関しては「電流は通電面積に比例し電圧は電極間距離(ゲル長)に比例する」という原則を覚えておくと便利でしょう。
例えば、2連の泳動槽でゲル1枚あたり20mAで泳動していて次に同条件で2枚泳動するのであれば40mAに設定します。
なお、論文用に綺麗な図を作成したい等の目的がある場合には、5mA程度の低い電流を設定することもあります。
ゲルの染色
タンパク質が分離された後、ゲルは染色されます。最も一般的な染色法は(Coomassie Brilliant Blue; クマシーブリリアントブルー)やシルバーステイン法を使用することです。染色により、タンパク質バンドが視覚化されます。
ゲル内にあるタンパクを染色することで、目的タンパクの有無や量を簡易的に調べることができます。
なお、CBB染色だけではタンパクが存在しない部分も染色されてしまうので、脱色液に数時間浸してから結果を見ます。
CBB染色→脱色後のゲルの様子は以下のようになります。
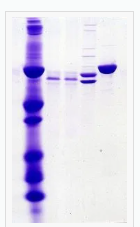
結果の解釈
染色されたゲルを解釈し、分離されたタンパク質バンドの位置と強度を分析します。分子量マーカーや対照サンプルと比較して、目的のタンパク質の分子量を特定します。
SDS-PAGEの応用
SDS-PAGEはさまざまな分野で幅広く応用されています。以下にいくつかの応用例を示します。
タンパク質の純度評価
SDS-PAGEはタンパク質の純度評価に使用されます。タンパク精製後、本当に精製されたか確認するためによく利用されます。
タンパク質の同定
SDS-PAGEだけでもタンパク質の同定はある程度は可能ですが、SDS-PAGEを2次元ゲル電気泳動(2D-PAGE)と組み合わせることで、より多くのタンパク質を同定できるようになります。これは、SDS-PAGEでは分子量が似たタンパク質を分離できなくても、別の指標(2次元目)により分離ができるようになるからです。
蛋白質分析
生物学的サンプル内のタンパク質の分析や、タンパク質の発現量の比較にも使用されます。ただしこの目的の場合、大抵はウエスタンブロッティングによる、より正確な分析をします。
分子生物学研究
分子生物学の研究において、タンパク質の機能や相互作用を解明するためにSDS-PAGEが利用されます。Pull Down Assayなどがその代表例です。
まとめ
SDS-PAGEはタンパク質分析の基本的な手法であり、タンパク質の分子量を推定し、純度評価や同定に利用されます。その原理と手法を理解し、適切に実施することは、生化学や分子生物学研究において不可欠なスキルです。




コメント